2018 GRC NPC
- 1 ng/ml IL8 for 7 days —> Zta expression
- Transcriptome data
- Small RNA-associated TLRs
- TLR3, TLR7
- TLR7 is involved..
2016 GRC NPC
很高興認識大家,在歐洲作這病毒的人較少且分散在很多地方彼此交流不易且個別領域也相差很大,也許因為鼻咽癌對他們來說發生機率微乎其微所以沒有如此整體性的研究且他們比較在意淋巴癌.相比較亞洲,看到如此多人做同領域且很努力要解決鼻咽癌問題其實蠻motivated研究動力的. 我的筆記比較像流水賬沒像林老師那麼精細,不過大家若有興趣可以參考. (https://goo.gl/PQiN9I)
很多posters其實很有趣但大多數都是在聊天沒實際作記錄 印象最深的幾個:
- 英國人: Drug that block EBNA1 binding loop to DNA to cure EBV+ tumours; 理論上很可行且可以成為治療EBV所有病的萬能藥,但是其實這構想很早就有了也有類似的小分子藥物,似乎也沒聽到有成果,拭目以待 (https://goo.gl/5njCTt) (SF: 5.6 millions, that’s a lot!!) 但是我們實驗室之前發現若把EBNA1幹掉後 其實EBV還是可以感染,雖然效率超低,但是反而變成更不好的形態。因為EBNA1KO的EBV會integrate into human genome to facilitate growth.
- 加拿大組: 那個奇怪的棒子可以直接SWAP鼻咽區域,在配合PCR來大規模檢測早期鼻咽癌 這研究者感覺很像慈善家,若這棒棒可以推廣並壓低成本可能可發現很多早期NPC病患提早治愈(張玉生老師 commented:長庚醫院侯勝博醫師及曾雁明醫師過去就以nasal swap取樣再進行EBVDNA PCR analysis)
- 日本人: 胃幽門桿菌可以使胃細胞的NRP-1大幅增加而提升EBV感染率 可能間接導致EBV胃癌
- 新加坡: 用EBVST (CD8) 治療stage 3-4的鼻咽癌病患,效果還不錯 到臨床三了然而他們用B95-8來刺激T細胞可能不正確 因為我們實驗室證實了不同的EBV株T cell clonality might only overlay 30-50%.
- 很多: LMP1, NFkB pathways and the association with NPC (many posters).
- 香港台灣: NPC is difficult to form cell line in vitro; requires Xenograft model.
- Microenviroment is important for the formation of NPC; crosstalk between tumor macrophage or myofibroblasts might alter TGFb, migration…etc. Might explain why it’s difficult to culture NPC cells in vitro.
- 香港中國: 一大堆大規模的NGS計劃在實行,錢好多 Sample也多,應該可以做些結論
- 香港正在克隆自己的EBV strains derived from HKNPCs,要比較M81是否真能完全represent NPC strain in Asia.
- 香港: Dennis Lo 正在發展sequence plasma DNA來預測是否有癌症,看起來很有前景
- 印尼: 發展快速檢驗試劑,一個1美金,可以快篩anti-VCA and anti-Dnase antibodies level.
1. 您的筆記我就拿來用囉 –> 根本來不及抄, 尤其免疫方面. 像Cliona Rooney那一場, 從你的筆記我才知道原來她是在說那些東西…感恩 感恩
YES 第一個演講相當精彩
2. 我們家目前在做Rta/BRLF1, 之前是發現dox-inducible Rta efficiently arrests cells in G1, followed by cellular senescence. 最近跟George Tsao要來NP460hTert (p16-deleted)及NP550hTert –> primary infection with Akata-GFP-EBV (cell-free virions 70X 濃縮) –> 48小時候以GFP當indicator, 在NP460中可測到近70%的綠光細胞, 在NP550則是螢光非常少, 符合460適合讓EBV潛伏感染、550適合走lytic cycle之理論. 目前我們在追查Rta在NP550走lytic cycle的這一組, 表現比例為何,是否會讓細胞senescence,或是誘導ROS產生等現象。
這點很怪因為我們也有NP460hTERT不過好像在我們這感染率一直不是很好,我最近再來玩玩看好了。我們克隆的M81雖然比Akata更有代表NPC strain的特性但是有個致命的缺點就是他會把F-plasmid在做病毒時丟掉(克隆在TR regions) 那時這樣設計是覺得如此產生的病毒將會完全丟到人工的基因片段如此可以作出真正的“WT”病毒 但是目前碰到的問題是被感染的細胞會沒有EBV marker (如GFP)可以去追蹤被感染的細胞,所以上皮細胞這部分做的很不順利 B細胞方面則沒啥問題 反正只有感染的B細胞能長起來,所以那篇BART只去看B細胞
八月份 EBV Meeting (Session 2: B cell infection)
The Epstein-Barr virus BART miRNA cluster of the nasopharyngeal carcinoma- associated M81 strain modulates lytic replication and cell growth in primary B cells
Ming-Han Tsai, German Cancer Research Institute, Heidelberg, Germany
我最近有想重新回去做上皮細胞 然後跟老板說能不能用這細胞株因為感染率高且被EBV感染的細胞能活 老板說不給做因為這細胞都已經immortalized了你如何再去用這細胞去看EBV感染是否能導致細胞immortalization 還在跟他爭論這個。他說沒那麼巧細胞剛好又沒有p16又剛好overexpress hTERT還剛好被EBV感染,無法模擬真實情況。很頭大,因為我嘗試過感染primary的上皮細胞,分離出EBV+的細胞,從來沒長起來過。若沒長起來那就無法研究了,特別是辛苦做出的BARTKO。 把BARTKO放回上皮細胞應該是非常重要的下一步。若他實在不同意我用這細胞株那只好就送給香港的實驗室去做唄。
Q1: 你們看到M81的Zta和其它人有些variation (這點在George Tsao報告的slide上也看得到, 不同NPC cell line的Zta在western blot就有不同大小),Rta呢? 有發現和B95-8/Mutu/Akata等variation很大的地方嗎? Rta DNA binding domain是在N端, C端為非常potent的TA domain.
1. 我們很少去看Rta 主要原因是1. M81deltaBRLF1一直做不出來, 且BZLF1 in B cells 細胞比較重要 上皮細胞似乎BRLF1比較重要 但我們搞很少上皮細胞又一直搞不出突變 但做BZLF1+BRLF1 double KO卻沒碰到啥問題。Protein size沒仔細去比較 且BRLF1很大,即使有差可能也不會太明顯。
Q2: 我們現在在算這個條件下, 到底是拿了多少的genome equivalent去做infection. 聽了你們的報告後, 我覺得我們這樣子用沈澱離心方式去製備病毒似乎費功、病毒容易失活、而且感染條件好像很“用力”.記得你跟我說你們的上清液 可以得到10^7-8 /ml 病毒顆粒, 所以在做cell free / direct infection primary NP cell時, 是否有再濃縮或是經過什麼特別處理?
2. 必須要做離心 離心目的除了是要把病毒濃縮,最重要的是移除FBS因為Cell一碰到FBS就分化了 就長不起來變得肥肥扁扁的 當然反正EBV感染後的細胞本來就長不起來 但是我們老板希望細胞保持原始狀態因為畢竟鼻咽癌細胞是屬於“未分化”的上皮細胞. 我也發現若細胞碰到FBS而分化的話感染力會大幅提升 可惜那時沒深究下去 後來被中國的實驗室發表了那些成球狀的上皮細胞(看起來是分化的)是因為表達了NMHCIIA不過在他們文章中好像沒提這些細胞被感染後能不能活 不過其實也很難說 說不定EBV感染分化的細胞後 之後讓細胞變回未分化狀態。至於用哪種模式就得你們自己決定了。離心病毒雖然費工夫但是不難。一般我是用100到500 MOI的M81去感染primary上皮細胞。感染率從3-60%都有,看是從哪個donor來的。(SF: 在EBV infects hTERT-NOK這一篇paper中, 結果第二段就是在講”EBV infection epigenetically hindered keratinocyte differentiation” 推測EBV infect成功後, 會降低IVL及gap juction formation)
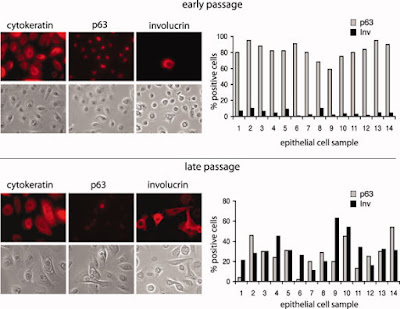
Q3: 要區分 NP cell 是否differentiated, 你們只用INV (involucrin) 就夠了嗎?
3. 我們用三個抗體判斷請見第一個圖
——————————
7/10 SF to MH
感謝分享你的寶貴經驗! 好好來定一下病毒MOI~
p16 methylation或deletion我覺得似乎是頭頸癌部pre-cancer lesion特有的步驟。記得George Tsao那一株NP460hTert, 似乎是in vitro養著養著, p16 gene就掉掉了!
MH: @完全同意,但老板不給做我也莫可奈何 嗚嗚
有關重要但較少人做的BRLF1, 這次EBV meeting有一個 Abstract: EBV2016-1162 The dominating promoter variation of BRLF1 in nasopharyngeal carcinoma endemic area contributes to high efficacy of Epstein-Barr virus reactivation (真的假的?)
MH: @這可能需要大量的資料庫以及實際實驗來證明,得看他paper出來之後才知道,最重要的還需要實驗證明,譬如克隆出一大堆不同BRLF1 promoter用luciferase等等
另外要請教幾個免疫方面的問題:
Q1: 文獻上immune suppression是 頭頸癌腫瘤微環境中 (HNC TME)的一個特質。如果 我把NPC xenograft建立在huMice皮下、NSG皮下, 然後比較二者Tumor/TME之異同,這在你們看來, 有沒有很奇怪。年初有篇XactMice paper做類似的實驗,發現唯有huMice才能真正反映F0組織之TME.
MH: @絕大多數EBV carcinomas都俱有高度淋巴球滲透的現象 用humanized mice來做且能長起來應該最能反映現況。若真的能長起來那麼會有很多題目可以做。(譬如把CD4幹掉 把CD8幹掉之後看結果之類的,或去分出這些T細胞看他們的抗原是啥)
Q2: Tsao和徐醫師他們皆以NOD-SCID做NPC xenograft, 如果換成NSG(or NOG), tumor taken rate會不會好一點?
MH: NSG一定比較好因為老鼠沒有CD132,這樣連NK都沒有
NOD是沒有CD25,SCID是沒有RAG以及相關在T/B cell 做clonal seletion的蛋白所以大多數T/B會死翹翹,但“很少數的”可能會活,NK理論上應該不受損
NSG的G是沒有common gamma chain (CD132) 如此IL2, IL7, IL15的receptor都沒有,這幾個是免疫細胞存活必要cytokines,如此將完全沒有T, B, NK等等
但實際結果哪個老鼠適合還得操作過才知道,理論上NSG應該是目前最強悍的免疫缺乏鼠。
我問過香港組為啥他們不用NSG他們理由是拿不到這老鼠且他們鼠房不提供相關支援養這老鼠,而不是他們不想用喲!
Q3: 我聽到Clio Rooney在她talk中說了二次”It is very difficult to make dendritic cells from NPC patients”. 到底是我聽錯, 還是怎麼一回事? 是在說治療時要用的DC cell嗎?
MH: @我聽到是很難拿到T細胞也可能聽錯,不過很怪的是這些EBV相關疾病的病人他們體內血液的免疫細胞極度困難在體外培養。他主要演講很大一部分在探討及研究如何快速在體外將這些病人的T細胞放大,但很多都不成功。
我不是專家啦,也不像老師您及其他台灣做EBV的權威等等,只是提供個人意見作參考 :D